房颤中的肌醇三磷酸受体与核钙研究
扫描二维码下载资源
资源介绍
房颤中的肌醇三磷酸受体与核钙研究
> Title: Inositol Trisphosphate Receptors and Nuclear Calcium in Atrial Fibrillation > Comments: 这篇论文深入探讨了心房颤动(房颤)发生时心肌细胞核内部发生的微观变化。研究发现,房颤会导致心肌细胞核内的钙离子浓度异常升高(核钙超载),其背后的元凶是核膜上的一种叫作 IP3R 的受体被异常激活,进而触发恶性信号通路,导致心脏电活动恶化。
房颤是临床上最常见的心律失常,其进行性发展的机制一直是心血管领域的未解之谜。目前临床很难阻断房颤从阵发性向持续性的恶化。这篇论文通过独到的视角,将目光从传统的细胞质钙离子转移到了细胞核内的钙离子调控上。研究者发现,房颤通过下调 miR-26a,解除了对 IP3R1 受体的抑制,导致核内钙超载,进而激活 CaMKII-HDAC4 信号轴,最终下调了关键的 L 型钙通道。这一发现为开发针对细胞核信号通路的精准治疗药物提供了全新的靶点。
【摘要】
本研究揭示了房颤(AF)改变心房肌细胞核钙及 CaMKII 相关信号传导的机制。研究人员发现房颤导致心房肌细胞核内 IP3 受体(特别是 IP3R1)表达上调,引发核钙超载。这种核钙升高激活了核内的 CaMKII,导致 HDAC4 核外转运,进而引起 L 型钙电流($I_{CaL}$)的下调。机制上,房颤导致 microRNA-26a 下调,解除了对 IP3R1 的抑制。
【引言】
- 研究背景: 房颤会导致心房电重构和收缩功能障碍,其中钙离子处理异常是关键。虽然细胞质钙离子的作用已被广泛研究,但细胞核内的钙离子信号在房颤中的变化及其对基因表达的调控作用尚不明确。
- 本文贡献:
- 贡献一:首次证实房颤会导致心房肌细胞核内舒张期钙离子浓度显著升高,并改变了核钙瞬变的动力学。
- 贡献二:明确了核膜上的 IP3R1 受体上调是导致核钙超载的主要原因,受 miR-26a 下调调控。
- 贡献三:揭示了“IP3R1 上调 -> 核钙超载 -> 核 CaMKII 激活 -> HDAC4 核外转运 -> L 型钙通道下调”的完整病理链条。
【实验设计】
- 实验对象:
- 动物模型:成年杂种犬,通过右心房快速起搏(600 bpm × 1 周)建立持续性房颤模型。
- 细胞模型:分离的犬心房肌细胞,体外快速起搏模拟房颤。
- 人体样本:来自窦性心律和长期房颤患者的心房组织样本。
- 测试条件: 利用共聚焦显微镜实时监测细胞核与细胞质的钙离子动态;使用 siRNA 和抑制剂干预信号通路。
【研究方法】
核心思路/总体框架: 建立房颤模型 -> 观测核钙变化 -> 锁定关键受体 IP3R -> 验证 CaMKII-HDAC4 信号轴 -> 确认 L 型钙电流功能重构。 关键模型/理论基础: 兴奋-转录偶联(Excitation-Transcription Coupling)。
原理: 细胞电活动引起的钙信号能进入核内,通过磷酸化转录因子或表观遗传修饰酶,调节基因表达实现结构重塑。
【结果与讨论】
图表核心内容:
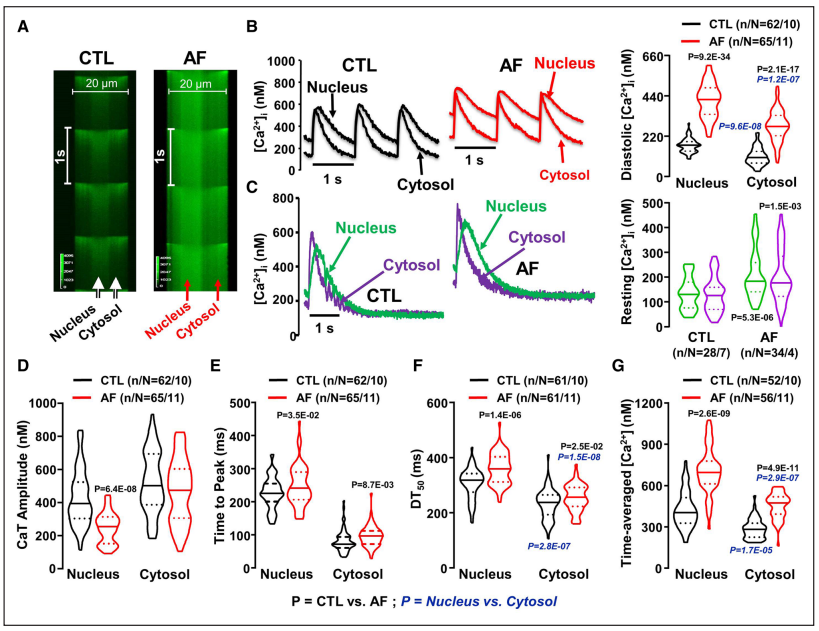
Figure 1 显示房颤犬心肌细胞的核内舒张期钙浓度显著高于对照组,且衰减速度明显减慢。
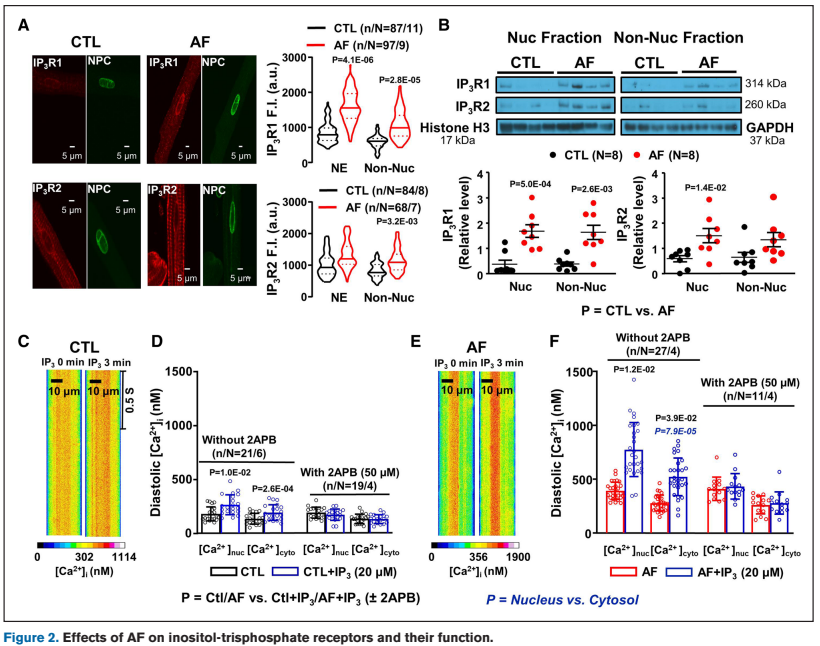
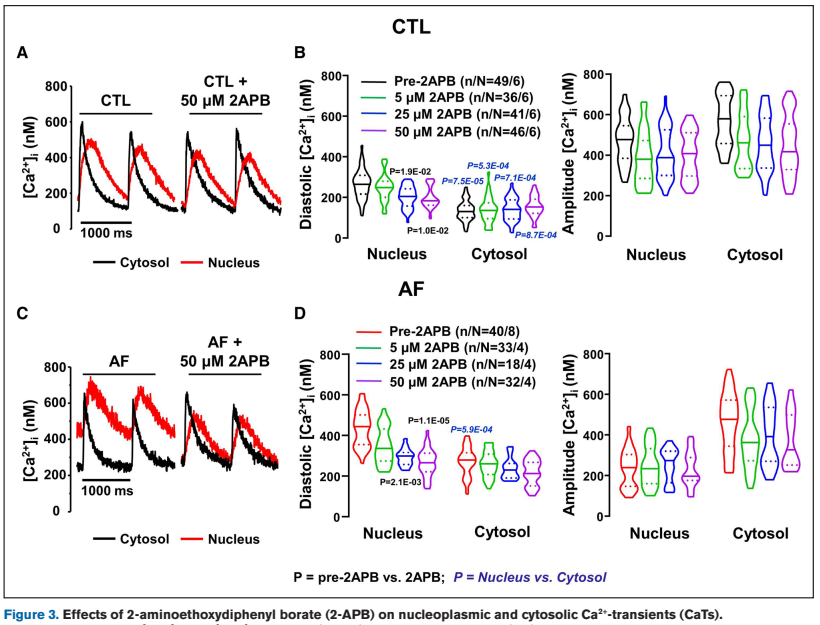
Figure 2 & 3 证实房颤导致核膜 IP3R1 蛋白显著增加,使用 IP3R 阻断剂(2-APB)可降低核钙。
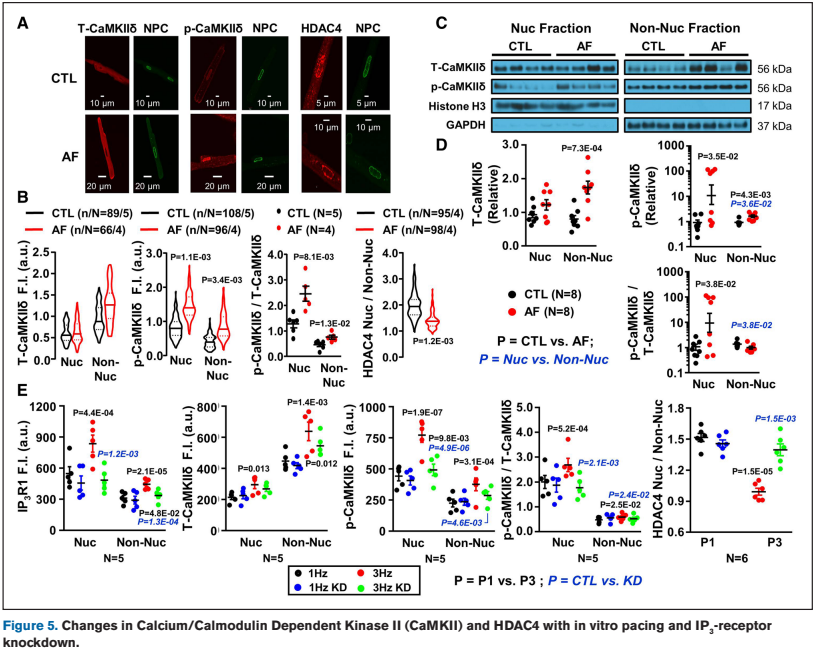
Figure 5 发现房颤导致核内 CaMKII 磷酸化升高,伴随核内 HDAC4 含量降低(即核外转运)。
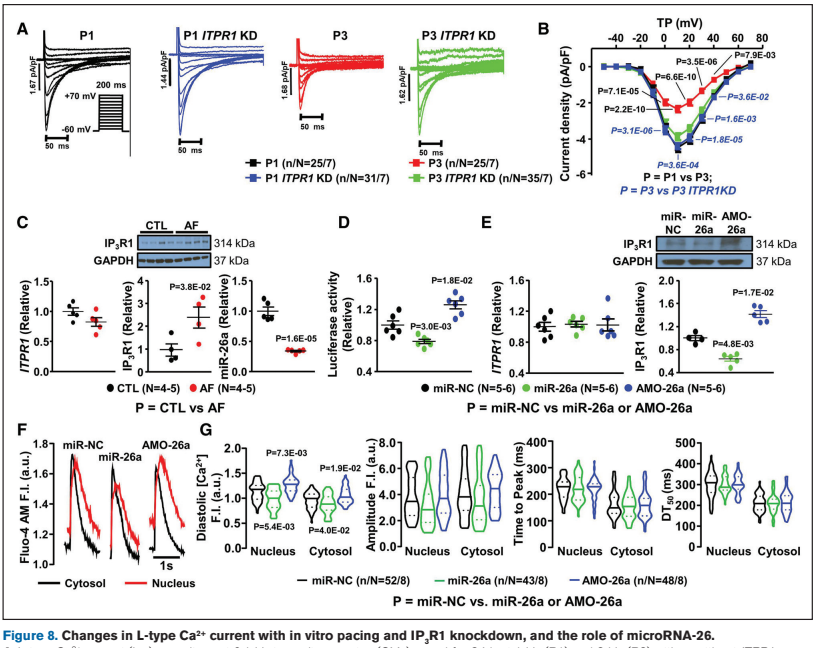
Figure 8 表明房颤中 miR-26a 显著下调,过表达 miR-26a 可抑制 IP3R1 并降低核钙。
主要发现: 房颤特异性地引起心房肌细胞核钙超载,由核膜 IP3R1 上调介导。这种变化激活核内 CaMKII,促使 HDAC4 排出,导致 L 型钙电流密度降低。
作者的解读: 房颤诱导的核钙升高形成了一个恶性正反馈循环,下调了 L 型钙电流,虽然起到了减少钙内流的保护作用,但同时也促进了房颤的维持。
【结论】
核心结论: 房颤通过下调 miR-26a 引发 IP3R1 上调,导致核钙超载并激活 CaMKII-HDAC4 通路,最终下调 L 型钙电流。(简单来说,房颤让细胞核“钙中毒”,发出了错误的基因调控指令,加剧了病情。)
【展望】
可以改进的地方: 研究未对 L 型钙通道下调的具体转录路径进行精细拆解;人体样本量仍有待扩大。
下一步工作: 探索阻断 IP3R1-CaMKII-HDAC4 轴是否能在体内逆转房颤;研究该通路对心房纤维化基因的调控作用。
文献详细信息
- 原文标题: Inositol Trisphosphate Receptors and Nuclear Calcium in Atrial Fibrillation
- 中文翻译: 房颤中的肌醇三磷酸受体与核钙研究
- 发表日期: 2021 年 3 月
- 期刊/来源: Circulation Research
- 作者机构: 加拿大蒙特利尔心脏研究所
- DOI 链接: 10.1161/CIRCRESAHA.120.317768
>本文所分享的原文内容来源于网络。原文著作权归原作者所有,仅为分享优质内容目的转发,学习与讨论,未用于商业盈利,若有侵权请联系删除。
下载说明
方式一:扫码获取
- 微信扫描下面图片二维码进入【飞享助手】小程序
- 点击复制即可自动复制下载链接

方式二:小程序获取
- 微信搜索小程序:飞享办公助手
- 点击导航栏:【提取】
- 输入关键词: ZcBzdv
- 点击【提取】即可获取资源链接